研究紹介
RESEARCHメタボロミクスによる COVID-19 の重症病態のメカニズムの解明
研究の背景
COVID-19 重症患者数の増加は病床圧迫・医療崩壊の主な原因として社会問題になっています。重症患者の多くは人工呼吸器による治療を必要とし、さらには ECMO(体外式膜型人工肺)と呼ばれる人工肺とポンプを用いた体外循環回路による治療が必要となることもあり、莫大な 医療資源が費やされます。またCOVID-19重症患者の死亡率は約20%と、依然として高いにも かかわらず重症患者特有の病態メカニズムは解明されておらず、重症患者に特化した治療薬は存在しません。重症患者の救命率向上や治療期間短縮、そして限られた医療資源を守るためには、COVID-19重症病態の解明やさらなる治療法の改善が強く求められています。
研究内容と目的
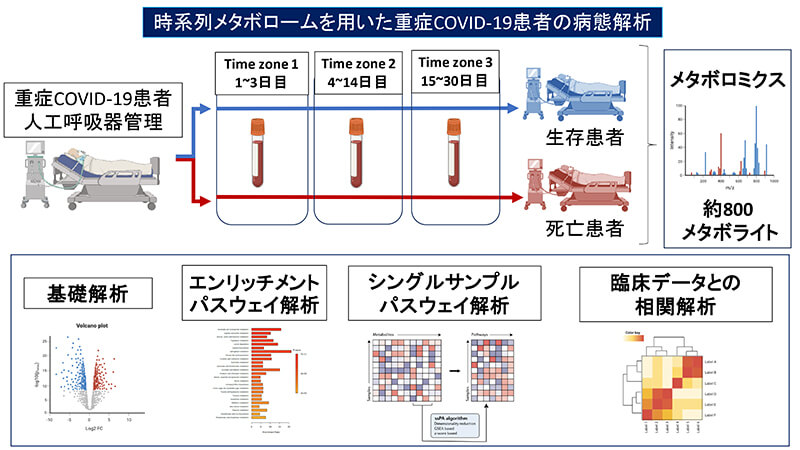
この度、東京医科歯科大学とHMT社は、COVID-19 患者の血液を用いてメタボローム解析※1を 行い、血液中に含まれる代謝物質を網羅的に分析することにより、重症病態の解明に取り組みます。 本研究では HMT社の提供するメタボローム解析データのみならず、東京医科歯科大学が保有するCOVID-19 重症患者データベースに記録された臨床情報や血液検査等の各種検査デー タを組み合わせます。そこに機械学習※2 等の最新のデータ解析手法を用いることで重症度と関連する代謝物質を特定し、病態のメカニズム解明を基盤とした新たな治療法の開発に貢献することを目的とします。
期待される成果
本研究により、COVID-19の重症度を特徴付ける代謝物質を特定し、病態の分子メカニズム を明らかにすることができれば、重症度に応じた適切な治療を施すことができ、病状のさらなる悪化や患者死亡を最小限に抑えられる可能性があり、ひいては医療現場の負担軽減に貢献することができます。また、COVID-19重症患者特有のメカニズムの解明は新たな薬剤標的の発見に繋がる可能性も期待されます。最後に、COVID-19のような新興呼吸器感染症の流行は約10年に一度のペースで起こっています。本研究で得られた知見は、近い将来起こりうる新たなパン デミックに対しても役に立つ可能性があります。
- メタボローム解析 メタボローム解析(メタボロミクス)は、細胞や生体内に存在する代謝物質を包括的に測定し、生命現象を総体的に理解 しようとする解析手法です。遺伝子を解析するゲノミクス、たんぱく質を解析するプロテオミクスなどとともに、生命科学に おける解析手法の一つとして注目されています。
- 機械学習 現在の AI の中核技術であり、コンピューターに大量のデータを読み込ませ反復的に学習させる事で、データに潜む特 徴やパターンを見つけ出す技術のことをいいます。
- 研究責任者
- 東京医科歯科大学医学部附属病院 集中治療科 内御堂亮
- 共同研究先
- ヒューマン・メタボローム・テクノロジーズ株式会社
重症 COVID-19
治療薬開発の前臨床試験に向けたマウス急性低酸素性呼吸不全モデルの開発
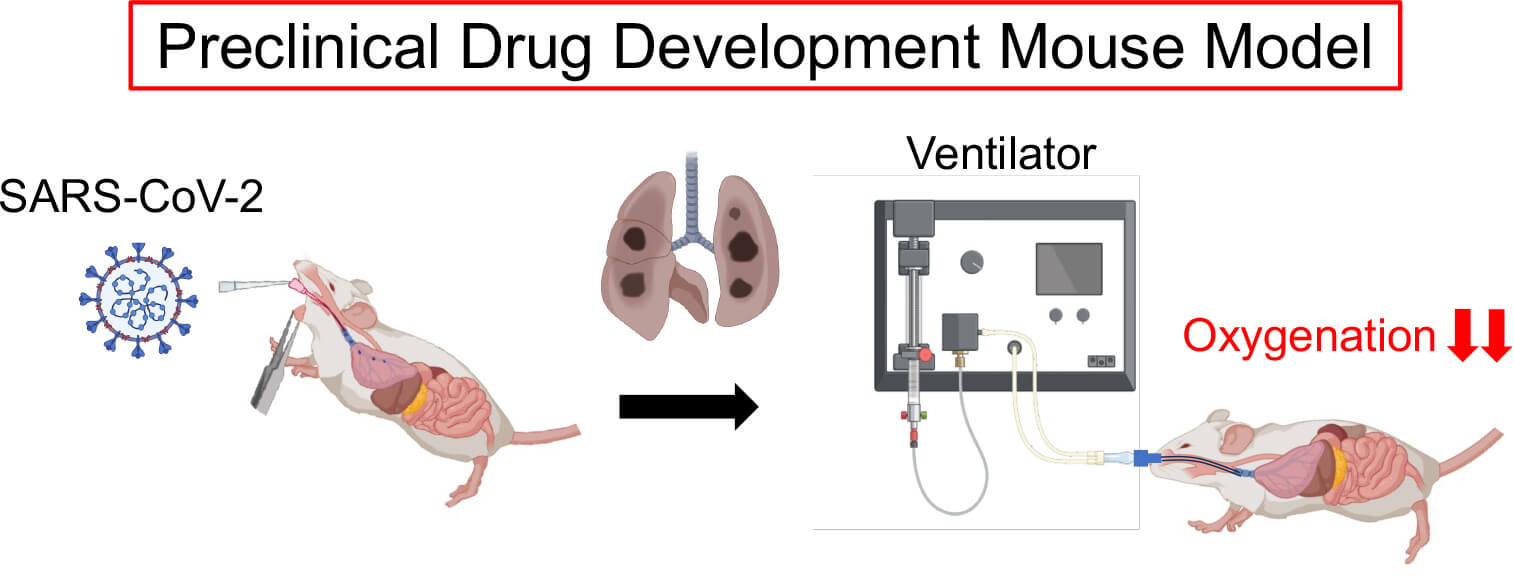
SARS-CoV-2は重症呼吸不全であるARDS(acute respiratory distress syndrome、急性呼吸窮迫症候群)を発症し、パンデミック時には重症治療薬の不足のため高い死亡率を呈した。ARDSは血管透過性亢進に伴う肺水腫による、急性の酸素化低下を主たる診断基準とする症候群で、コロナ前から集中治療室(ICU)の主たる入室理由であったが、疾患概念の提唱から 50 年以上経過する現在も ARDS 全体に対する特異的薬物療法は存在していない。ARDS における新規薬剤のトランスレーショナル・リサーチがnegative studyを重ねてきた理由として、前臨床試験が臨床上の鍵となる病態、すなわち肺水腫の進展・呼吸機能低下・酸素化不全などを十分反映してこなかった事が挙げられる。そのため、BSL3施設内に生理学的指標を正確に測定できる実験系を整備し、臨床的意義の高い前臨床試験の基盤を確立し、今後の創薬開発を加速させることを目標としている。
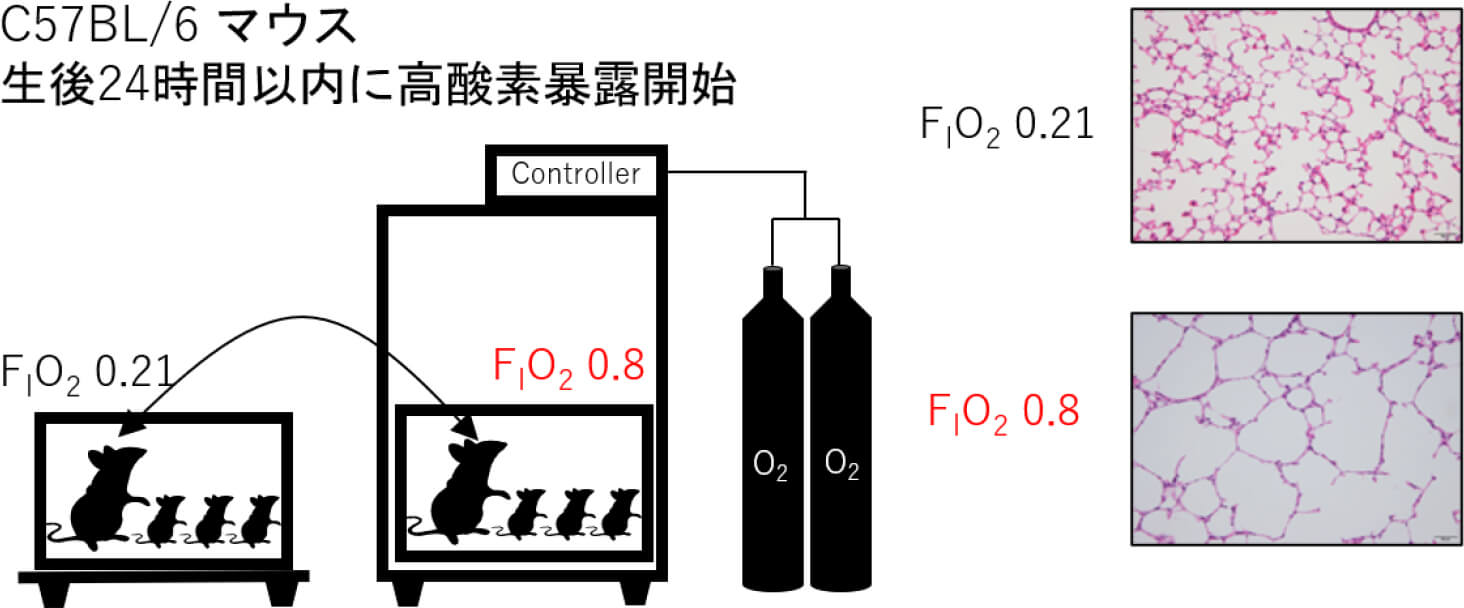
高濃度酸素曝露による
新生児慢性肺疾患モデル
ECMOにおけるmicrovesiclesの臓器障害に対する役割の検討
体外式膜型人工肺(ECMO: Extracorporeal Membrane Oxygenation)は、最重症の呼吸・循環不全患者に用いられる長期使用型人工心肺装置である。重症インフルエンザ肺炎の致死率を低下させた臨床研究を契機として2010年頃からECMO症例数は世界的に増加し、関連機器や管理の質も格段に向上した。しかし、炎症の伝播による多臓器不全や血栓性・出血性合併症のため、依然としてECMO症例の致死率は50%程度と高値である。ECMO管理中の生理学的な理解や工学的な技術発展は認める一方で、ECMO管理中の生物学的反応は未だ不明な点が多い。そこでmicrovesiclesの解析を通してECMO管理中において問題となる多臓器不全の発症機序について明らかにすることを目的とし、より安全で効果的な ECMO を用いた治療や、より優れた ECMO 回路の開発につながることを目標としている。
模擬ECMOモデルを用いたMV解析

- 研究責任者
- 東京医科歯科大学大学院医歯学総合研究科 生体集中管理学分野 教授 若林健二
新生児慢性肺疾患におけるmicrovesiclesの役割と免疫学的機序の解明
新生児慢性肺疾患(CLD : chronic lung disease)は低出生体重児として出生後の新生児集中治療室治療後の最大の合併症であり、社会経済的にも影響が大きい疾患である。 出生後の NICU 内における CLD 進行防止の為に有効とされる主な治療は、水分量制限や人工呼吸器設定調整などの支持療法がその中心である。病因に関しては、胎内・生後のステロイド投与がCLD の予防や、一時的な呼吸状態改善に効果を挙げる事などから、炎症性サイトカインの CLD に おける影響は大きな話題の一つである。一方で詳細な病態生理には不明な点も多く、分子標的薬などのより選択的かつ効果的である可能性を有する治療法は未だ確立されていない。そこでmicrovesiclesの解析を通して CLD の病因を明らかにすることを目的として研究を進めている。
- 研究責任者
- 東京医科歯科大学大学院医歯学総合研究科 生体集中管理学分野 教授 若林健二
経時的遺伝子発現解析を用いた敗血症慢性重症経過の病態解明と予測モデル構築
敗血症は細菌やウィルス感染により重篤な臓器障害が生じた致死的な症候群である。近年の早期治療の発達により早期死亡率は減少したが、重症のまま治療期間が2週間を超える慢性重症経過患者が増え、その死亡率が40%と高いことが新たな課題となっている。現状、慢性化した敗血症に対する特異的な治療はなく、病態の解明が喫緊の課題である。我々の先行研究から遺伝子発現解析を用いて急性期敗血症の遺伝子発現プロファイルを同定し、過剰な炎症と免疫抑制、エネルギー代謝亢進が起こることが分かっている。
過去研究に基づき本研究では下記の2点を行う。(1).敗血症慢性重症経過の遺伝子発現プロファイルと遺伝子発現制御機構を同定し病態解明にアプローチする、(2).敗血症慢性重症経過に陥るリスクを可視化するのに効果的な遺伝子発現インデックスを機械学習・深層学習を用いて構築する。本研究で用いるデータはマイクロアレイ並びにRNAシークエンスを用いた遺伝子発現解析により取得し、研究成果を通して実臨床の観点から敗血症慢性重症経過の病態解明並びに早期予測・予防に貢献する。
- 研究責任者
- 東京医科歯科大学医学部附属病院 集中治療科 内御堂亮
- 共同研究先
- 東京医科歯科大学M&Dデータ科学センター AI・ビッグデータ研究部門 統合解析分野 長谷川 嵩矩
- 研究資金
- 令和3年度科学研究費助成事業(学術研究助成基金助成金) 基盤研究(C)(一般) 令和3年度~ 令和5年度